Evaluación sobre usos excesivos y deficientes de la vitamina B12
Exceso y Deficiencia de Vitamina B12: Consecuencias Clínicas e Interacciones Antioxidantes con el Glutatión
MSc. Ing. Roque Masciarelli
Universidad Tecnológica Nacional, facultad Regional Rosario, Argentina
roque.masciarelli@gmail.com
Citar: J. PAIME, 2025, 4, 52-60
Rosario, 12 de diciembre 2025
Resumen
Esta revisión analiza las consecuencias clínicas tanto del consumo excesivo como de la deficiencia de vitamina B12, y explora su interacción bioquímica con el glutatión. El consumo excesivo se ha asociado con náuseas, trastornos digestivos, fracturas óseas, disfunción renal y síntomas neurológicos. La deficiencia está bien establecida como causa de anemia perniciosa, neuropatías, debilidad y fatiga, y puede incrementar indirectamente el estrés oxidativo al alterar el equilibrio del glutatión. Más allá de estos hechos clínicos, el manuscrito plantea la hipótesis de que la vitamina B12 podría ejercer efectos antioxidantes a través de sus características estructurales y su sinergia con el glutatión. Esta perspectiva interpretativa resalta el posible papel de la B12 en la mitigación del estrés oxidativo y de enfermedades relacionadas con la edad, lo que requiere validación experimental adicional.
Palabras clave:
Vitamina B12
Cobalamina
Glutatión
Estrés oxidativo
Defensa antioxidante
Anemia perniciosa
Enfermedades neurodegenerativas
Especies reactivas de oxígeno (ROS)
Más detalles en el documento adjunto.
https://doc.uni75paime.org/Vitamina.B12-Masciarelli_v5.pdf
Vitamin B12 Excess and Deficiency: Clinical Consequences and Antioxidant Interactions with Glutathione
MSc. Ing. Roque Masciarelli
Universidad Tecnológica Nacional, facultad Regional Rosario, Argentina
roque.masciarelli@gmail.com
Citar: J. PAIME, 2025, 4, 42-48
Rosario, 12 de diciembre 2025
Abstract
This review examines the clinical consequences of both excessive intake and deficiency of vitamin B12, while exploring its biochemical interplay with glutathione. Excessive consumption has been associated with nausea, digestive disorders, bone fractures, kidney dysfunction, and neurological symptoms. Deficiency is well established as a cause of pernicious anemia, neuropathies, weakness, and fatigue, and may indirectly increase oxidative stress by impairing glutathione balance. Beyond these clinical facts, the manuscript hypothesizes that vitamin B12 may exert antioxidant effects through structural features and its synergy with glutathione. This interpretive perspective highlights the potential role of B12 in mitigating oxidative stress and age-related diseases, warranting further experimental validation.
Keywords
Vitamin B12
Cobalamin
Glutathione
Oxidative stress
Antioxidant defense
Pernicious anemia
Neurodegenerative diseases
Reactive oxygen species (ROS)
1. Antecedentes
Basado en conocimientos anteriores sobre las estructuras químicas desarrolladas de los polifenoles y flavonoides de vegetales, comparadas con las estructuras en equilibrio de sus formas genéricas aldehídicas y cetónicas, relacionadas con los polialcoholes y cetonas, he deducido observando la compleja estructura de la vitamina B12, que podrían existir posibilidades de encontrar algunas cualidades antioxidantes, ya sea directa como indirectamente.
Estructura aldehídica del aldehído u cetónicaßà Estructura enólica de ambas
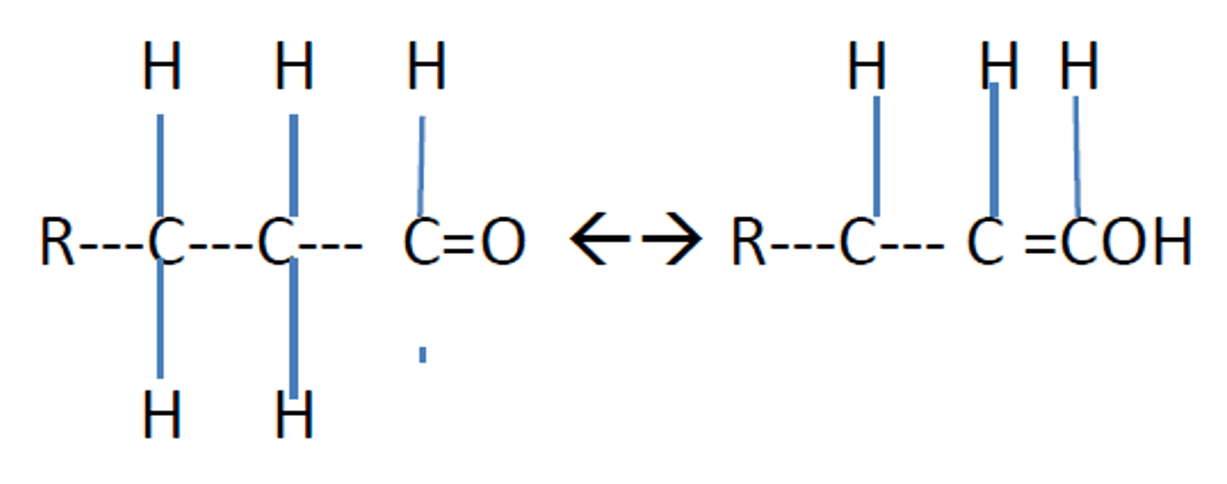
Figura 1. Forma aldehídica del aldehído Forma enólica del aldehído
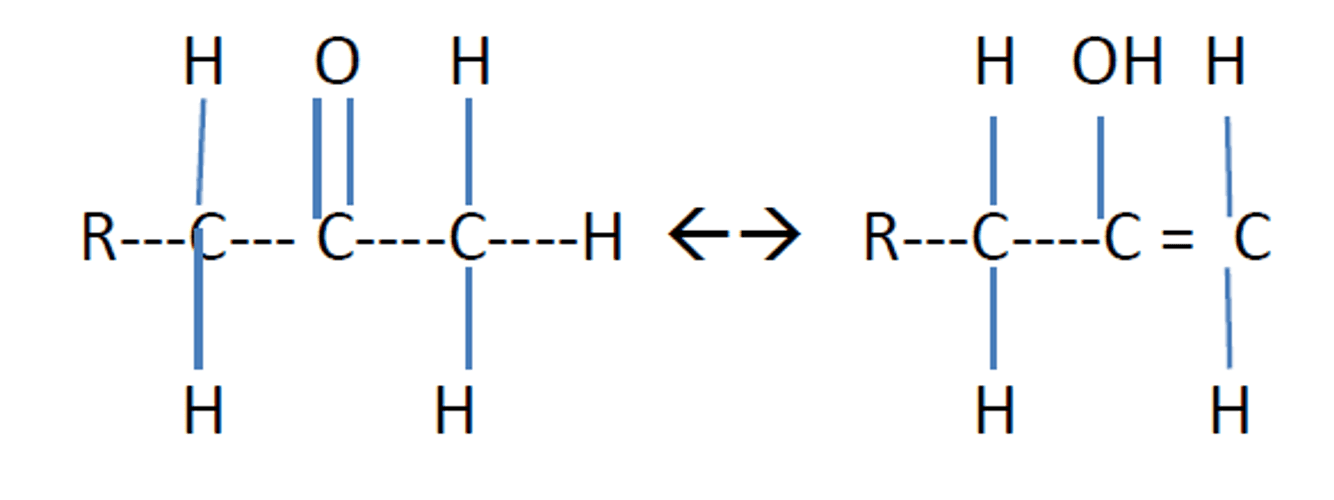
Figura 2. Forma cetónica de la acetona Forma enólica de la acetona
(considerado un alcohol secundario)
Como el fenol es una estructura alcohólica, también comercialmente, se lo suele conocer como ácido fénico. En rigor, tomando como base la estructura del mismo y de acuerdo a sus formas de resonancia, surge la estructura del ion fenóxido (Figura 3) donde el átomo de oxígeno unido al anillo, queda rodeado de seis electrones, de los cuales, comparte uno con el enlace covalente del anillo y otro con el del hidrógeno.
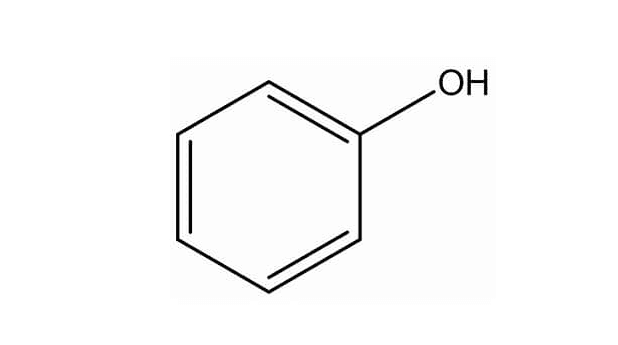
Figura 3. Estructura del ion fenóxido
El ion fenóxido expuesto por los cinco electrones restantes, conformándolo también como un radical libre, mientras que el correspondiente al átomo de hidrógeno, lo hace con un electrón, constituyendo per se un radical libre, ya que posee un electrón no apareado H*. Ambos, con un número impar de electrones buscarán la manera de estabilizarse robando un electrón de otra molécula, estabilizándola. Obviamente que ambos se desplazan conjuntamente oxidándose.
En general, los antioxidantes ejercen su actividad eliminando radicales libres, proporcionándoles electrones o hidrógeno. En consonancia con este mecanismo, un antioxidante interactúa directamente con un radical libre y neutraliza sus electrones libres. {1}
De acuerdo a lo expresado anteriormente, surge mi análisis comparativo de la estructura de la vitamina B12, para asimilarla a su posible capacidad antioxidante.
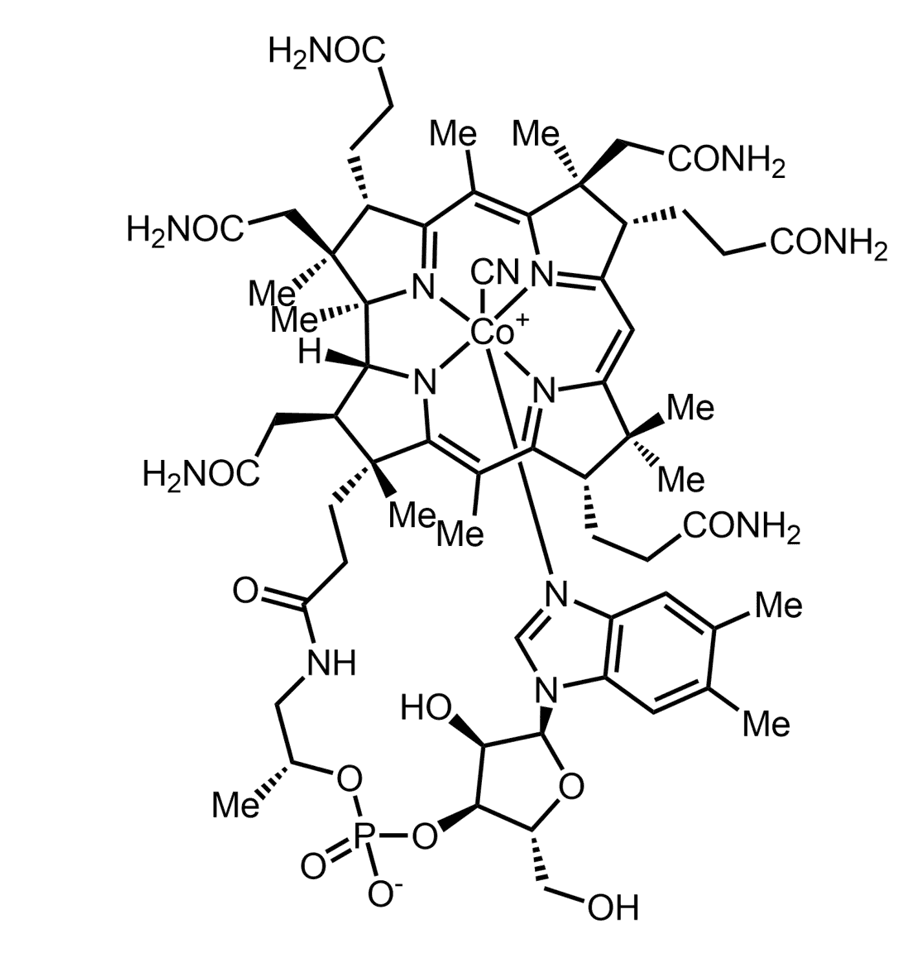
Figura 4. Estructura química desarrollada de la Vitamina B12, también denominada cianocobalamina, donde pueden observarse dos grupos oxhidrilo y un grupo cetónico.
La vitamina B12 (Figura 4), es una de las más complejas y la única que presenta un núcleo central metálico de cobalto; dando lugar a las cobalaminas, que adoptan diferentes estructuras químicas, según la variación del estado de oxidación del cobalto (Co+1, Co+2 o Co+3).
La cobalamina es hidrosoluble, esencial para el normal funcionamiento del cerebro, del sistema nervioso, la formación de la sangre y de varias proteínas. Está involucrada en el metabolismo de las células del cuerpo humano, síntesis y regulación del ADN, aminoácidos, ácidos grasos y glúcidos- Su biosíntesis se produce solo por bacterias, generando hidroxicobalamina, pero la conversión entre las distintas vitaminas B12, se producen en el cuerpo humano. Una forma semisintética de la misma es la cianocobalamina, de amplio uso en productos farmacéuticos, suplementos vitamínicos, y aditivos alimentarios. La vitamina B12, predomina en los siguientes alimentos: germen de trigo-carne-huevos-pescados y verduras.{2}
2. MATERIALES Y METODOS
La interacción entre la Vitamina B12 y glutatión fue descubierta por su relación con la anemia perniciosa, que destruye las células epiteliales, las que son encargadas de la secreción del ácido estomacal y de la producción del glutatión, potente antioxidante metabólico que resulta crucial para la absorción de la B12. La B12, ingerida como suplemento, para ser convenientemente absorbida, primeramente, debe interactuar con el Factor intrínseco (FI, glicoproteína, generada por las células epiteliales del estómago) y producen el glutatión reducido, el cual es un poderoso antioxidante que neutraliza las especies reactivas de oxígeno, actuando como defensa del organismo. El FI, ayuda a la absorción, para que la B12 pueda pasar al torrente sanguíneo, cosa que se produce en la parte inferior del intestino delgado. La vitamina B12, se produce en mayor proporción en el hígado y está constituida por varias estructuras isómeras complejas, como la cianocobalamina, generalmente utilizada en la formulación de suplementos. La cianocobalamina, activa la formación del glutatión disminuyendo los niveles del ion superóxido que es un poderoso oxidante y esto no conduce a incrementar el estrés oxidativo y la aparición de enfermedades vinculadas con la edad: Alzheimer-Parkinson-diabetes tipo 2. {3} De manera informativa, se puede agregar la existencia de compuestos polifenólicos, derivados de los vegetales destacada acción antioxidante, que contribuyen a neutralizar a los radicales libres formados metabólicamente en el organismo. {4}
El glutatión se forma en el interior de las células, para proteger del daño oxidativo a todo el cuerpo, incluyendo el estómago. Es decir, el glutatión participa en el proceso de desintoxicación y de regeneración celular, se encuentra presente en el estómago, pero su síntesis no está relacionada con la B12 en dicha ubicación. La síntesis del glutatión, ocurre principalmente en todos los órganos, incluyendo el revestimiento epitelial del estómago, mediante dos etapas enzimáticas.
3. Estructura química desarrollada del glutatión reducido.
En la cual pueden observarse dos grupos ceto, característicos
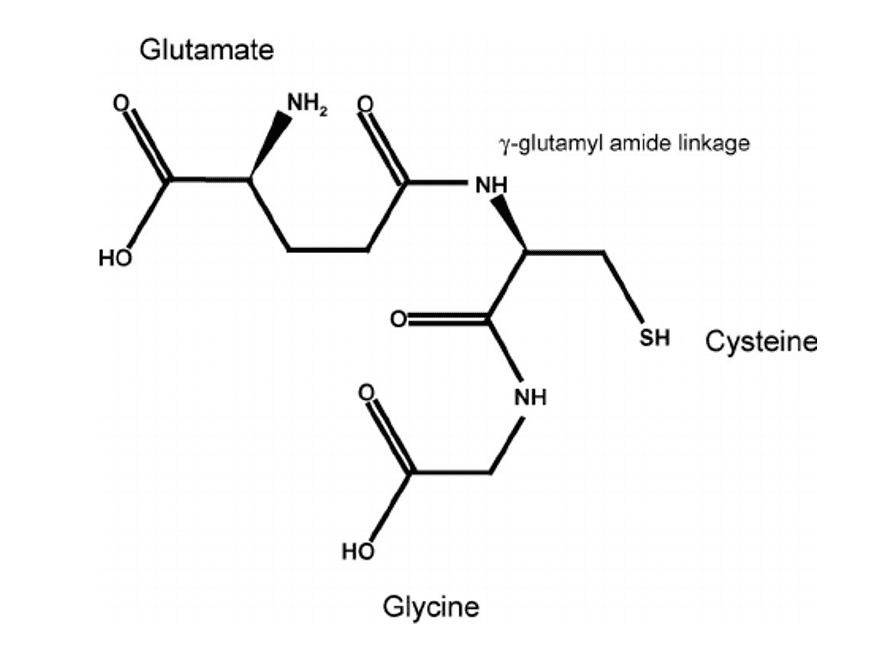
Figura 5. Estructura del glutatión reducido.{5}
La carencia de B12 y de FI provocan anemia perniciosa. Químicamente el glutatión es un tripéptido, constituido por los aminoácidos: glutámico, cisteína y glicina. Actúa como el principal antioxidante celular; protege células hepáticas, y neutraliza a productos químicos tóxicos (RADICALES LIBRES) o especies reactivas de oxígeno (ROS). Así su forma de glutatión reducido (sulfhidrato), al captar electrones no apareados de los ROS, se transforma en disulfuro.{6}
El glutatión predomina en las crucíferas (brócoli, coliflor, espinacas, calabazas, semillas, espárragos), ajo, cebollas, aguacate, carnes magras y productos de origen animal como carne de pollo, de ternera y productos lácteos crudos o poco procesados. Estos alimentos, no solo proporcionan glutatión directamente, sino que también aportan aminoácidos y azufre, para que el organismo sintetice su propio glutatión.
4. Reacción antioxidante del glutatión
Ante la presencia de ROS, que representamos como la oxidante agua oxigenada. Se da la reacción: iones sulfhidrato —> iones disulfuro
H2O2 + 2 GSH —> GSSG + 2 H2O
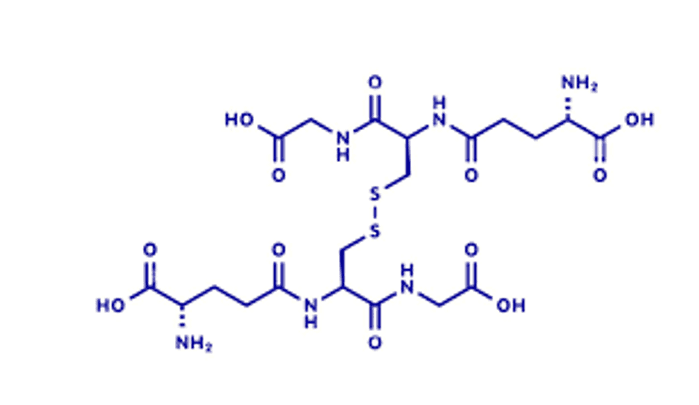
Figura 6. Estructura del glutatión oxidado.
Dicha reacción, expresa oxidación del glutatión reducido. El glutatión, conjuntamente con la vitamina B12, actúan como un tampón celular, manteniendo un verdadero equilibrio inmunológico, en células y tejidos sanos, la versión reducida, alcanza más del 90% y menos del 10 %, lo hace en su forma disulfuro u oxidada. Desempeña un rol fundamental en numerosas reacciones metabólicas y bioquímicas, tales como síntesis y reparación de ADN, transporte de aminoácidos y actividad de enzimas. Por lo tanto, los sistemas del organismo, pueden verse afectados, por el estado del sistema glutatión, influyendo en el sistema nervioso, gastrointestinal y los pulmones. {6}
Para la clínica médica, generalmente se designa glutatión para el estado oxidado, correspondiente a la formación de iones disulfuro. {7}
Normalmente Las células eucariotas, extinguen continuamente a los radicales libres a través de antioxidantes endógenos. Además, la B12, puede estimular indirectamente la eliminación de las ROS, mediante la preservación del glutatión. {8, 9}
5. Relaciones clínicas importantes sobre el estado de un cuerpo sano
Así se define la siguiente relación con datos analíticos, que permiten brindar un panorama clínico de los pacientes con algún tipo de cáncer.
a-Glutatión reducido/ glutatión oxidado < 1; indica un peor estado de salud, respecto a un estado de control
El glutatión oxidado, para análisis clínicos de pacientes con cáncer de cerebro, mama y de pulmón, de cuello uterino tiende a ser elevado
b-Glutatión reducido/ glutatión oxidado > 1, indica un mejor estado de salud con referencia a un estado de control
O sea, los carcinomas con grados elevado indican niveles de glutatión más bajos. {10}
Eventualmente podría definirse un grado de conversión en la reacción química oportunamente planteada, respecto al glutatión reducido. Definición obtenida del concepto de conversión {11}
Contenido de glutatión inicial o de control =Cgi
Contenido de glutatión en un estado posterior=Cgp
Luego: la Conversión glutatión reducido = (Cgi - Cgp)/Cgi
6. RESULTADOS
Por otra parte Meister y Anderson {12} reportaron para acción tampón del glutatión , valores de concentración oscilando entre 0.5-10 mM
Potenciales de oxido-reducción, para el glutatión reducido, en función del pH
pH Potencial de reducción |
7.4 -264 mV |
7 -240 mV |
7. Ingesta diaria recomendada de Vitamina B12
La ingesta diaria recomendada para hombres y mujeres adultas es de 2.4 micro g/dia. Aunque estudios recientes, {13} proponen que una dieta de 6 micro gr/día puede resultar más adecuada, para la población en general. El estrés oxidativo ocurre cuando la presencia de ROS, exceden la capacidad amortiguadora disponible.{14, 15}
8. CONCLUSIONES
9. CONCLUSIONS
Clinically, both excess and deficiency of vitamin B12 have significant health consequences, ranging from digestive and neurological symptoms to pernicious anemia. Biochemically, vitamin B12 supports glutathione metabolism, indirectly contributing to antioxidant defense. While the direct antioxidant role of B12 remains hypothetical, its synergy with glutathione provides a plausible mechanism for reducing reactive oxygen species and maintaining cellular redox balance. This dual perspective—established clinical evidence and interpretive biochemical hypotheses—underscores the importance of adequate B12 intake and highlights areas for future research.
10. REFERENCIAS BIBLIOGRÁFICAS
Piluzza G, Bullitta S. Correlations between phenolic content and antioxidant properties in twenty-four plant species of traditional ethnoveterinary use in the Mediterranean area. Pharm Biol. 2011;49(3):240‑7. doi:10.3109/13880209.2010.501083.
Sinclair L. Recognizing, treating and understanding pernicious anaemia. J R Soc Med. 2008;101(5):262‑4. doi:10.1258/jrsm.2008.081006.
Calderón‑Ospina CA, Nava‑Mesa MO. B Vitamins in the nervous system: Current knowledge of the biochemical modes of action and synergies of thiamine, pyridoxine, and cobalamin. CNS Neurosci Ther. 2020;26(1):5‑13. doi:10.1111/cns.13207.
Pérez‑Jiménez J, Arranz S, Tabernero M, Díaz‑Rubio ME, Serrano J, Goñi I, Saura‑Calixto F. Updated methodology to determine antioxidant capacity in plant foods, oils and beverages: Extraction, measurement and expression of results. Food Res Int. 2008;41(3):274‑85. doi:10.1016/j.foodres.2007.12.004.
Franco R, Schoneveld OJ, Pappa A, Panayiotidis MI. The central role of glutathione in the pathophysiology of human diseases. Arch Physiol Biochem. 2007;113(4‑5):234‑58. doi:10.1080/13813450701661198.
Meister A. Glutathione metabolism and its selective modification. J Biol Chem. 1988;263(33):17205‑8. doi:10.1016/S0021-9258(19)77815-6.
Damodaran S, Parkin KL, Fennema OR. Fennema’s Food Chemistry. Boca Raton: CRC Press; 2007.
Manzanares W, Hardy G. Vitamin B12: the forgotten micronutrient for critical care. Curr Opin Clin Nutr Metab Care. 2010;13(6):662‑8. doi:10.1097/MCO.0b013e32833dfaec.
Karamshetty V, Acharya JD, Ghaskadbi S, Goel P. Mathematical modeling of glutathione status in type 2 diabetics with vitamin B12 deficiency. Front Cell Dev Biol. 2016;4:16. doi:10.3389/fcell.2016.00016.
Gamcsik MP, Kasibhatla MS, Teeter SD, Colvin OM. Glutathione levels in human tumors. Biomarkers. 2012;17(8):671‑91. doi:10.3109/1354750X.2012.715672.
Levenspiel O. Chemical Reaction Engineering. 3rd ed. New Delhi: Wiley India Pvt. Limited; 2006.
Meister A, Anderson ME. Glutathione. Annu Rev Biochem. 1983;52:711‑60. doi:10.1146/annurev.bi.52.070183.003431.
Bor MV, Lydeking‑Olsen E, Møller J, Nexø E. A daily intake of approximately 6 µg vitamin B‑12 appears to saturate all the vitamin B‑12‑related variables in Danish postmenopausal women. Am J Clin Nutr. 2006;83(1):52‑8. doi:10.1093/ajcn/83.1.52.
Czerska M, Mikołajewska K, Zieliński M, Gromadzińska J, Wąsowicz W. Today’s oxidative stress markers. Med Pr. 2015;66(3):393‑405. doi:10.13075/mp.5893.00137.
Pisoschi AM, Pop A. The role of antioxidants in the chemistry of oxidative stress: A review. Eur J Med Chem. 2015;97:55‑74. doi:10.1016/j.ejmech.2015.04.040.
Vitamina Estrés oxidativo Neurodegenerativas
© ExpoNet 2024
