Digital Twins for Heart Health: An ecosystem
Digital Twins of the Heart: An Ecosystem
MSc. Ing. Saúl Rodríguez Astucuri
ExpoNet Sistemas - saulr@exponet.es
Citar: J. PAIME, 2025, 4, 27-51
Madrid, 31 de diciembre 2025
Resumen
Más detalles en el documento adjunto.
https://doc.uni75paime.org/Digital_Twins_for_Health.pdf
Abstract
This article describes the theoretical steps for formulating a digital twin ecosystem of the heart for patients with irregular and rapid heart rhythm variations. To this end, it lists electrostatic simulations of the membrane separating cells in cardiac tissue, reviews the advantages of the various open-source platforms currently available, and addresses the data governance necessary for advanced analytics and AI model training, as well as the need to use agile methodologies for twin development. Along this path, it describes the different efforts to validate the digital evidence of the various electrostatic and AI models with real-time patient clinical data. It demonstrates the strategic potential of digital twins of the heart, highlighting the main digital twins of the heart currently in operation in Spain.
1. Introducción
Los gemelos digitales son elementos virtuales de un objeto, sistema o proceso físico que permiten simular, monitorear y optimizar su comportamiento en tiempo real. Se basa en la integración de modelos físicos, datos de sensores conectados en tiempo real y algoritmos de IA para mejorar la toma de decisiones y la eficiencia operativa, de tal forma que permite prever en tiempo real las funciones de su versión física real del objeto, sistema o proceso.
Las características claves de un gemelo digital de un corazón humano son la permanente conexión y medición de datos clínicos, utilizando sensores y modelos computacionales de simulación para evaluar escenarios y optimizar sus funciones y a su vez para recopilar datos y reflejar en tiempo real los cambios y condiciones operativas del corazón.
2. Marco teórico: Electrofisiología del corazón
Hoy en día, los modelos computacionales permiten crear representaciones personalizadas de la electrofisiología cardíaca de un paciente y virtualizarlos en gemelos digitales del corazón. Gracias al modelo personalizado, se puede obtener información sobre la dinámica de propagación eléctrica y utilizarla para sugerir tratamientos personalizados.
A continuación, se muestra un tejido cardiaco en la figura 1, que está compuesto por células del miocardio, se identifica el núcleo de una célula y las membranas que separan las células por esas líneas curvas blancas en la ampliación gráfica de la izquierda.
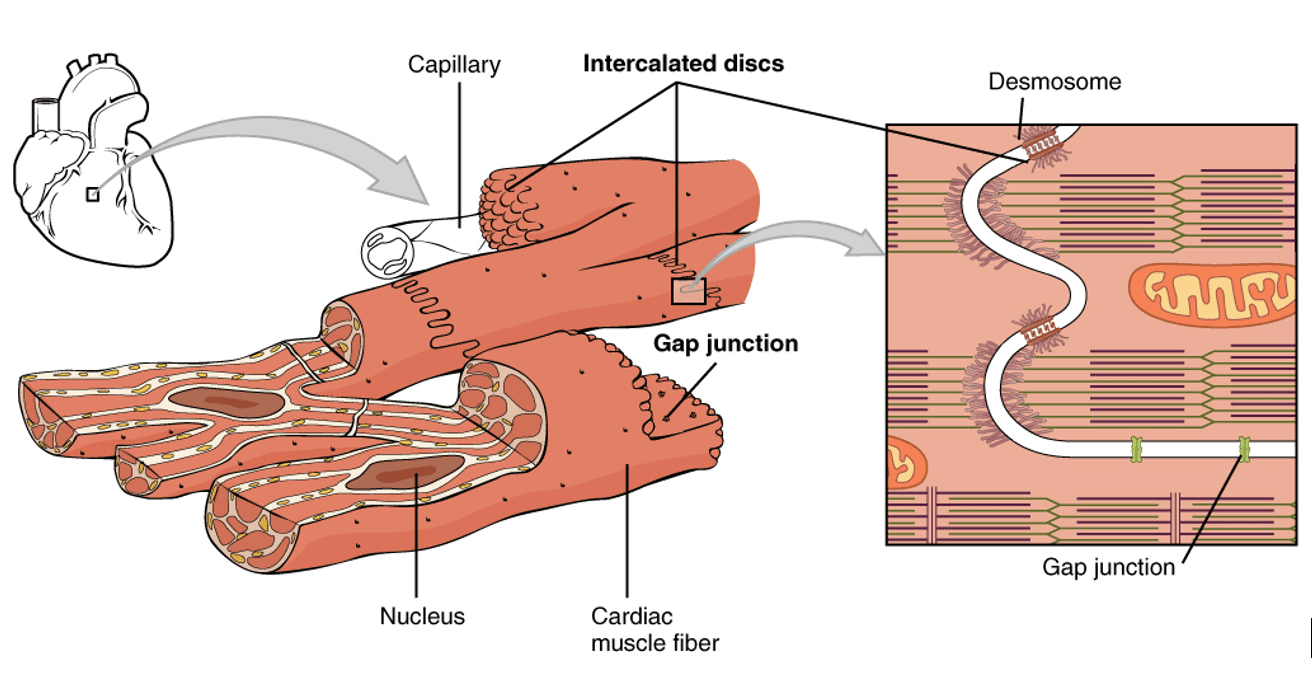
Figura 1. Al observar un fragmento de tejido cardíaco, se observa que las células cardíacas tienen muchas conexiones entre sí. Las bifurcaciones tienen pequeños puntos que se proyectan y no hay realmente ninguna conexión lateral. Ahí están todas las conexiones. Estas líneas onduladas (Intercalated discs), son por donde las células se comunican, es decir, las células se mueven, ya que, si fueran rígidas, las estructuras se desgarrarían. Si se observa con más detalle estas líneas onduladas, son parte de la membrana celular que rodea la fibra del musculo cardiomiocito de las células del músculo cardíaco y que contienen uniones en hendidura (Gap junction) y desmosomas (Desmosome) que facilitan el flujo electrostático (Fuente: https://en.wikipedia.org/wiki/Cardiac_muscle#/media/File:1020_Cardiac_Muscle.jpg)
Ahora bien, tenemos dos dominios separados por una membrana: uno intracelular y otro extracelular. Tenemos un espacio dentro de la célula y otro fuera de ella. Luego, asumimos que estos dominios, están separados por una membrana y que existen en todas partes, y son continuos e inter penetrantes. Esto significa que, dentro de cierto volumen, y en cualquier punto, existe un espacio intracelular.
En la figura 2, mostramos un equivalente eléctrico de la electrostática de la membrana celular {2}.
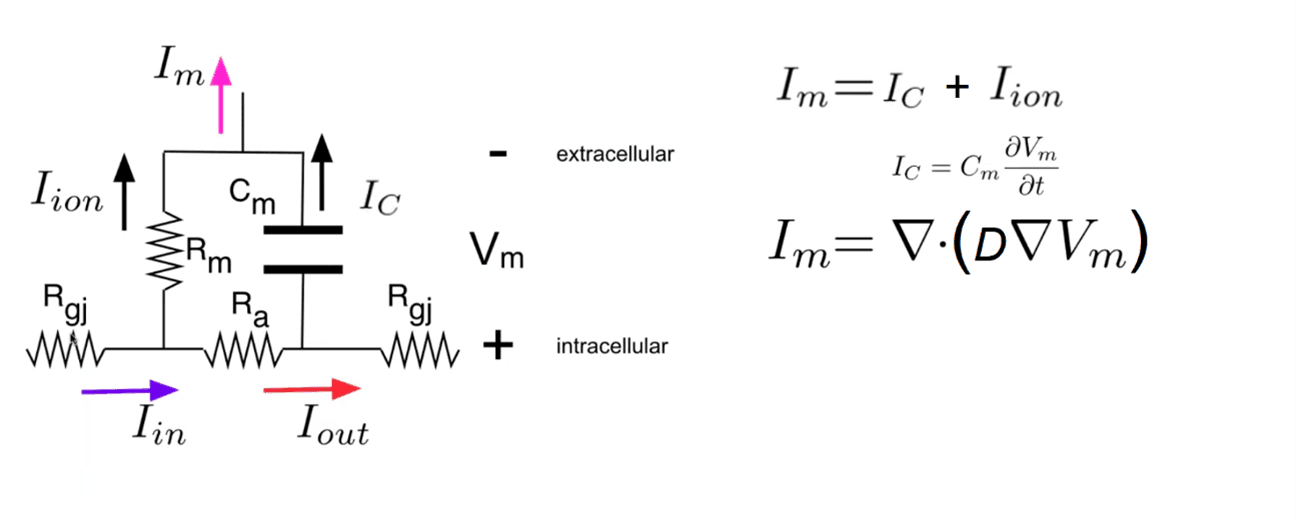
Figura 2. La representación electrostática más simple de una membrana celular es simplemente una resistencia en paralelo con el condensador. Es simplemente una resistencia pasiva, a la que llamamos Rm, y un condensador Cm. Y representamos unión en hendidura (Gap junction) con RGJ. Asumimos que, para amplitudes bajas, la membrana no está activa. La flecha violeta representa la corriente que fluye desde la celda aguas arriba Iin. Y luego tenemos la flecha roja que indica el punto de corriente Iout hacia la celda aguas abajo y hay un voltaje Vm a través del condensador, y por supuesto, hay una corriente Im que fluye fuera de la membrana (gradiente). La corriente que fluye más afuera de la membrana, en la representación del gráfico se muestra como Iin menos Iout que es igual a Iion más Ic, y asi mismo, Im es igual a la corriente que fluye a través del condensador más el flujo de corriente de cualquier canal iónico que Rm represente, y podemos escribirlo en forma diferencial con el operador laplaciano . ∇2 Simplemente indica que la divergencia del gradiente del campo escalar de potencial es la densidad de corriente en ese punto. Entonces, la corriente que atraviesa la membrana se puede considerar como un caso simple: una onda plana que viaja desde la parte inferior de la lámina hasta la parte superior. (Fuente: Descripción general de las simulaciones de electrofisiología cardíaca. https://opencarp.org/documentation/video-tutorials y propia.)
3. Modelo celular
Como parte del flujo de corriente a través de la membrana, tenemos una de las corrientes iónicas dadas en el término Iion, que varía según el tipo del ion que fluye por tanto su resistencia pasiva Rm. Existen modelos in silico para calcular computacionalmente el potencial de acción auricular humano y una muy reconocida es el Modelo Celular para el potencial de acción auricular humano, desarrollado por Courtemanche–Ramirez–Nattel (CRN, 1998) {3}, que:
Incluye varios iones esenciales de sodio, potasio, calcio y cloro circulan en el corazón, permitiendo que el músculo cardíaco genere impulsos eléctricos y se contraiga rítmicamente. Es decir, incluye flujos de corrientes iónicas: INa, ICaL, Ito, IKr, IKs, IK1, IKur, INaCa, INaK, etc.
Permite reproducir el potencial de acción auricular humano en condiciones normales y patológicas (ej. fibrilación auricular).
Estas membranas que unen células realmente tienen un potencial eléctrico, a manera de un condensador y un flujo de corriente por las junturas (Gap junction) que unen las células sobre las membranas. Justamente, a través de los tejidos del corazón circulan iones que permiten que el músculo cardíaco genere impulsos eléctricos y se contraiga rítmicamente, es decir flujos de corriente iónica.
4. Modelo BIDOMINIO: Electrostática del corazón
El investigador, Tung, Leslie del MIT en 1978 {2}. Nos dejó un estudio aplicado a la electrofisiología cardiaca desde el punto de vista electrostático de circuitos eléctricos, a través el modelo bidominio, simulando el funcionamiento del corazón con el potencial de corriente continua del miocardio isquémico, es decir, la actividad eléctrica de un tejido. El estudio se titula “Un modelo bidominio para describir los potenciales de corriente continua en miocárdicos isquémicos”.
Este modelo, tiene en particular dos términos, el primero para medir las densidades corrientes del modo común y el segundo el potencial de modo diferencial que están alrededor de la membrana que separa las células.
Las soluciones generales para el potencial extracelular o intracelular en una estructura bidominio se componen de dos términos: uno compartido por las estructuras mono dominio (aplica la ecuación de Laplace, llamada parabólica porque tiene una derivada temporal de primer orden) y otro exclusivo de las estructuras bidominio (aplica la ecuación de Helmholtz, llamada elíptica y básicamente no hay tiempo en esta ecuación. Así que en realidad lo hace un poco más difícil de resolver).
Además, las simulaciones eikonales son una forma computacionalmente eficiente de simular la propagación de la excitación del miocardio. Por otro lado, para conocer el potencial extracelular o intracelular del corazón, es suficiente un mapa de potencial de superficie de los tejidos del corazón y se puede calcular utilizando un modelo bidominio. Sin embargo, resolver el modelo bidominio es computacionalmente costoso debido a la alta precisión en la simulación de los mapas de potencial de superficie, pero se puede simplificar con los modelos mono dominio para calcular el mapa de potencial de la superficie del corazón de una manera rápida y menos precisa.
5. Modelo MONO DOMINIO: Membrana del corazón
Se asocia que el modelo de electrostático representa el potencial y la corriente total de la membrana Im igual a la corriente que fluye a través del condensador más el flujo de corriente Iion de cualquier canal iónico que Rm represente (Gap junction). Además, el potencial de acción resultante en el término Iion, se incorporará dentro del modelo mono dominio, describiendo cómo se propaga la excitación en el tejido auricular.
En definitiva, esa corriente de la membrana no es otra cosa que la divergencia de producto del tensor de difusión por el gradiente del potencial.
Por tanto, la ecuación diferencial del modelo mono dominio, se escribe como una ecuación diferencia parcial (PDE) en la siguiente figura 3.
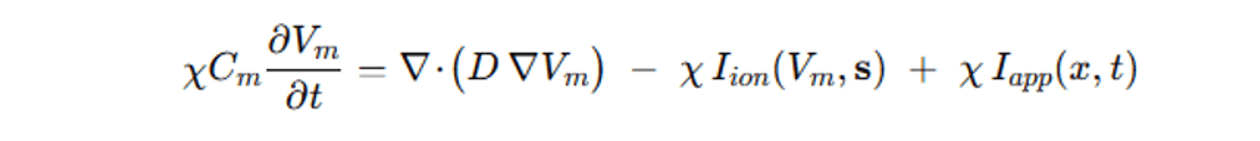
Figura 3. La ecuación diferencial del modelo mono dominio tiene las siguientes variables:
Vm=ϕi−ϕe: potencial transmembrana (diferencia entre potencial intracelular y extracelular).
S: variables del modelo iónico (puertas, concentraciones)
χ: relación área de membrana / volumen del tejido p.ej. χ=1400 cm-1.
Cm: capacitancia de membrana p.ej. Cm=1 μ F/cm2.
D: tensor de difusión anisotrópico, que modela la anisotropía del tejido cardíaco (dirección de fibras miocárdicas).
Iion(Vm,s): suma de corrientes iónicas que dependen del potencial de acción auricular humano y de variables de estado s (modelo celular, p.ej. CRN auricular humano, puertas de activación, concentración de Ca²⁺, Na⁺, K⁺, etc.).
Iapp: estímulos aplicados o corriente externa aplicada (ej. Estímulo eléctrico artificial)
Condiciones:
· Inicial: Vm(x,0) = V0(x), s(x,0) = s0(x) (estado en reposo).
· Frontera (Neumann natural, tejido aislado): (D∇Vm)⋅n=0 en ∂Ω.
Fuente: GPT-5 con razonamiento avanzado
La ecuación exacta define que la gradiente del potencial existente en la membrana es igual al flujo de corriente de la membrana, menos la corriente iónica que está pasando por las junturas verdes, más un flujo de corriente de estímulos externos aplicados por los sensores o instrumentos médicos.
Las características principales de aplicación del modelo mono dominio son:
Reducción de complejidad respecto a la ecuación exacta del modelo bidominio (que usa dos ecuaciones acopladas elípticas), el modelo mono dominio resuelve solo una ecuación exacta temporal, siendo más eficiente computacionalmente con la variable tiempo en el potencial eléctrico del condensador y en el estímulo eléctrico externo.
Anisotropía: el tensor de difusión D ajusta la propagación eléctrica según la orientación de fibras auriculares (gradiente), es decir a manera de redes de conducción a nivel de tejido.
Acoplamiento multiescalar: combina las corrientes iónicas del modelo celular (Iion channel) con el modelo tisular (propagación Vm y tensor de difusión anisotrópico D).
Aplicación clínica: se usa para estudiar arritmias auriculares, evaluar terapias farmacológicas y planificar ablaciones en fibrilación auricular.
6. Extraer, Transformar y Cargar DATOS
Hasta este primer momento, se ha preparado el modelo computacional que simula la electrofisiología del corazón que genera datos clínicos virtuales muy similares a los datos clínicos del paciente.
Sin embargo, es muy conveniente combinar los datos o extraer datos complementarios de los otros dispositivos quirúrgicos que hubiere, transformarlos de manera consistente o simplemente limpiar los datos. En esta transformación se tiene que corregir, si acaso hubiera algún dato erróneo.
La tecnología de gemelos digitales va más allá de las imágenes médicas tradicionales, porque se les permite utilizar datos digitalizados casi en tiempo real, al igual que los comercios actuales.
Estos modelos computacionales tridimensionales integran información digital obtenida mediante resonancia magnética, registros médicos electrónicos, de la historia clínica electrónica, antecedentes familiares, secuenciación de ADN, datos demográficos como sexo y edad, estudios bioquímicos, variables fisiológicas y factores ambientales. Esta integración multidimensional permite crear una réplica digital que se actualiza continuamente, facilitando la simulación del comportamiento dinámico del corazón en tiempo real.
Los gemelos digitales del corazón son en potencia un generador de datos digitales para la analítica avanzada y la inteligencia artificial.
Y finalmente cargar esos datos complementarios al algoritmo de IA. A partir de este punto se abre el último ciclo de iteración de entrenamiento del modelo de IA por el Data Analyst.
La tarea de transformación normalmente consiste en el 80% de trabajo global y es realizado por el Data Engineer.
En segundo lugar, después de que los con datos clínicos virtuales, el modelo IA ha sido entrenado y ya busca discernir situaciones específicas de la patología en la que haya sido entrenado.
Mantengamos la ventaja de que el gemelo digital esta potencialmente preparado para generar datos en tiempo real hacia adelante o de forma paralela a los datos clínicos que tenga el paciente.
Por lo cual, al generar datos hacia adelante, sin participación, sin tocar el corazón del paciente, se está prediciendo el comportamiento futuro del corazón del paciente. En definitiva, se puede conocer el funcionamiento futuro del corazón.
Es decir, después de replicar en tiempo real el corazón del paciente en el gemelo digital, se puede realizar pruebas diagnósticas de fármacos: primero en el gemelo digital y cuando decida el medico la mejor terapia, recién se proporcionaría la terapia seleccionada al paciente.
En definitiva, esta tecnología no sustituye al cuidado humano ni a la experiencia médica, pero le proporciona herramientas mucho más precisas al equipo médico para tomar decisiones personalizadas.
7. Plataformas abiertas de Simulación Cardiaca
Existen simuladores software de la electrofisiología cardíaca abierta para experimentos con fines académicos.
Las plataformas abiertas más utilizadas para simular la electrofisiología y el comportamiento del corazón humano son: OpenCOR, OpenCARP, Chaste, existen otras herramientas relevantes como Myokit, OpenCMISS, FEniCS / FEniCSx y plataformas auxiliares.
A continuación, y en primer lugar, mostramos la plataforma OpenCOR en la figura 4, que permite simular modelos celulares con el lenguaje declarativo cellML, para validar y probar con un análisis rápido de modelos iónicos; con una potente interfaz gráfica. CellML ha sido desarrollado por el Instituto de Bioingeniería de Auckland en la Universidad de Auckland - Nueva Zelanda y grupos de investigación afiliados. {9}
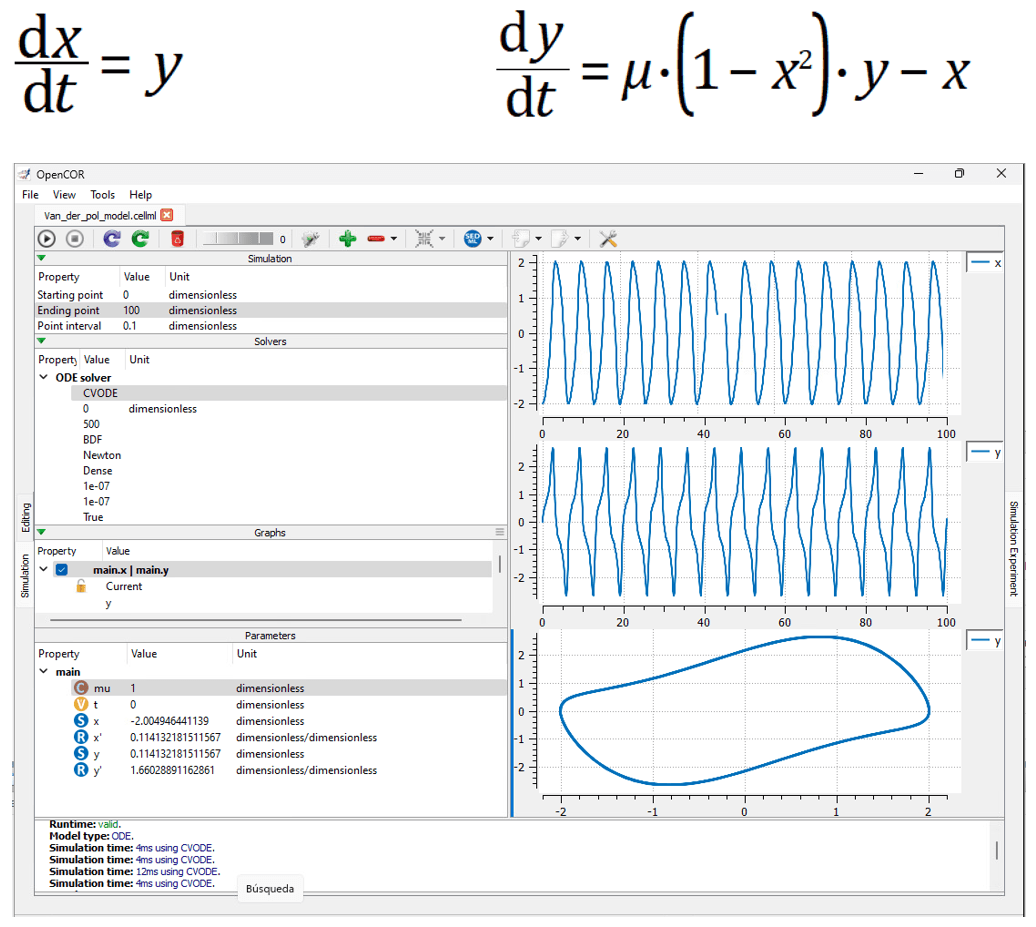
Figura 4. Plataforma OpenCOR Version 0.8.3 con el modelo simple y que también se puede utilizar el modelo celular CRN (Fuente: propia)
El modelo celular auricular humano de Courtemanche–Ramirez–Nattel para el término Iion está disponible el código abierto para la plataforma OpenCOR. {10}
La segunda plataforma abierta OPENCARP, es un simulador de electrofisiología cardiaca multiescalar específico de órgano completo (desde célula a órgano); es una plataforma potente que ofrece utilidades en CARPutils (Python) para automatizar el pre/post procesado y compartir experimentos reproducibles. Disponible gratuitamente con fines académicos. Para la visualización, OpenCARP incluye utilidades como Meshalyzer, y JupyterLab workflows. La gobernanza de la plataforma se lleva con las siguientes instituciones alemanas: NumeriCor GmbH, Instituto de Tecnología de Karlsruhe - Alemania, IHU Liryc Burdeos, Universidad Médica de Graz. {11}
La utilización de la plataforma abierta OPENCARP, permite escalar el modelo bidominio para completar la simulación a nivel de todos los tejidos del corazón.
En cierto modo, el dominio intracelular u extracelular se entrelazan, se interponen, de modo que existen en todas partes. Además, la corriente sale de un dominio y entra en otro, por lo que no puede destruirse. Si sale del dominio extracelular, debe fluir hacia las células adicionales, a este proceso le llamamos homogeneización de las células. En lugar de trabajar con una célula discreta, muestreamos un volumen y obtenemos las propiedades sobre dicho volumen, y luego decimos que es constante en todo el espacio. Así que homogeneizamos sobre el dominio de la infraestructura seleccionada, es decir, se necesita solo un dominio de infraestructura para encontrar la solución. En la figura 5, solo hay que elegir volúmenes lo suficientemente grandes como para que las propiedades sean constantes, lo que significa que el volumen que se homogeneiza debe ser mayor que una célula para utilizar los modelos de simulación.
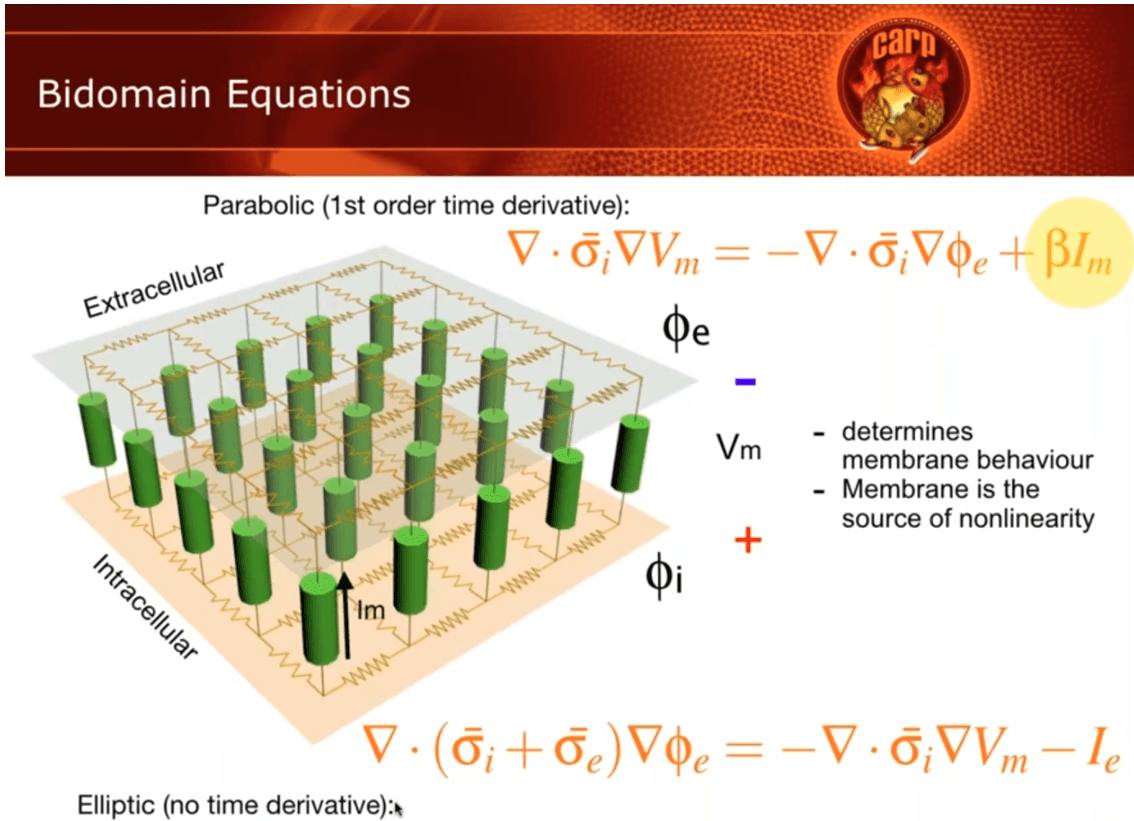
Figura 5. Aquí hay una representación gráfica del dominio Vm. Supongamos que tenemos un espacio extracelular, que es el medio lineal, que es básicamente un medio resistivo, de modo que, si se le aplica voltaje o carga, se cargará, básicamente, como planos de resistores. Lo mismo aplica para el espacio intracelular, que tienen un medio lineal. Sin embargo, al conectar ambos, tenemos estos pequeños fragmentos de membrana que dibujamos en verde, y estas membranas presentan linealidades no lineales, lo que la hace interesante. La ecuación bidominio se puede reescribir con mayor frecuencia en dos ecuaciones. La ecuación superior se llama parabólica porque tiene una derivada temporal de primer orden. No es obvio cuando se escribe así, pero en el término Im tenemos una primera derivada para la corriente capacitiva dβ por dt. Esto hace que esta ecuación sea parabólica. Y para la segunda ecuación inferior, esta es una elíptica y básicamente no existe la variable tiempo durante esta ecuación. Así que en realidad lo hace un poco más difícil de resolver. (Fuente: Descripción general de las simulaciones de electrofisiología cardíaca. https://opencarp.org/documentation/video-tutorials.)
La plataforma OPENCARP se caracteriza por que tiene un simulador de electrofisiología de órgano completo, permitiendo que se simule y que se reutilice el gemelo digital en otros laboratorios, es decir, disponer que se reproduzca un gemelo digital en otro laboratorio. Esta característica de reproducibilidad permite verificar que se confía en ese software que se está desarrollando.
La tercera plataforma Chaste (Cancer, Heart and Soft Tissue Environment) es una librería C++ robusta y verificada para simulaciones cardíacas a gran escala y con requerimiento de computación de alto rendimiento en biología y fisiología. La funcionalidad actual incluye electrofisiología a nivel de tejido y células, modelado de tejidos discretos y modelado de tejidos blandos. El paquete está siendo desarrollado por un equipo basado principalmente en el Grupo de Biología Computacional del Departamento de Ciencias de la Computación de la Universidad de Oxford, y el desarrollo se basa en la experiencia de la ingeniería de software, la computación de alto rendimiento, el modelado matemático y la computación científica. {12}
La cuarta herramienta Myokit es ligera y muy práctica para simulación y análisis de modelos celulares de miocitos cardíacos y su electrofisiología; tiene buena interfaz Python para experimentos y exportaciones. Útil para validar o comprobar modelos iónicos. Fue creado en la Universidad de Maastricht, y se desarrolló aún más en la Universidad de Oxford y la Universidad de Nottingham. {13}
Para utilizar las plataformas abiertas que están ligadas a instituciones universitarias de investigación, se requiere que toda investigación se publiquen los resultados del código abierto e inclusive con los datos o parámetros.
En realidad, son muy necesarios últimamente que se publiquen los datos a fin de verificar la confiabilidad del código abierto. Sin embargo, las entidades que financian esas investigaciones muchas veces no permiten esa licencia de publicar datos. Además, es necesario cumplir estrictas y exhaustivas cláusulas de identificación y responsabilidad académica demostrada, a partir de este hito, el camino es prometedor para centros de investigación.
En general, todas las plataformas pretenden que se utilice para este fin. Por lo cual, estas herramientas están a disposición y se puede utilizar bajo ciertos requisitos como Centro de Investigación, entonces lo importante está en que, si alguien de lo que están en nuestra escucha, desean realizar pruebas o desean participar en estas plataformas, solamente hay que buscarlas, asociarse con un Centro de Investigación, ver qué tipo de patología se quiere resolver y adelante.
8. Esquema de procesos y preparación inicial del modelo IA
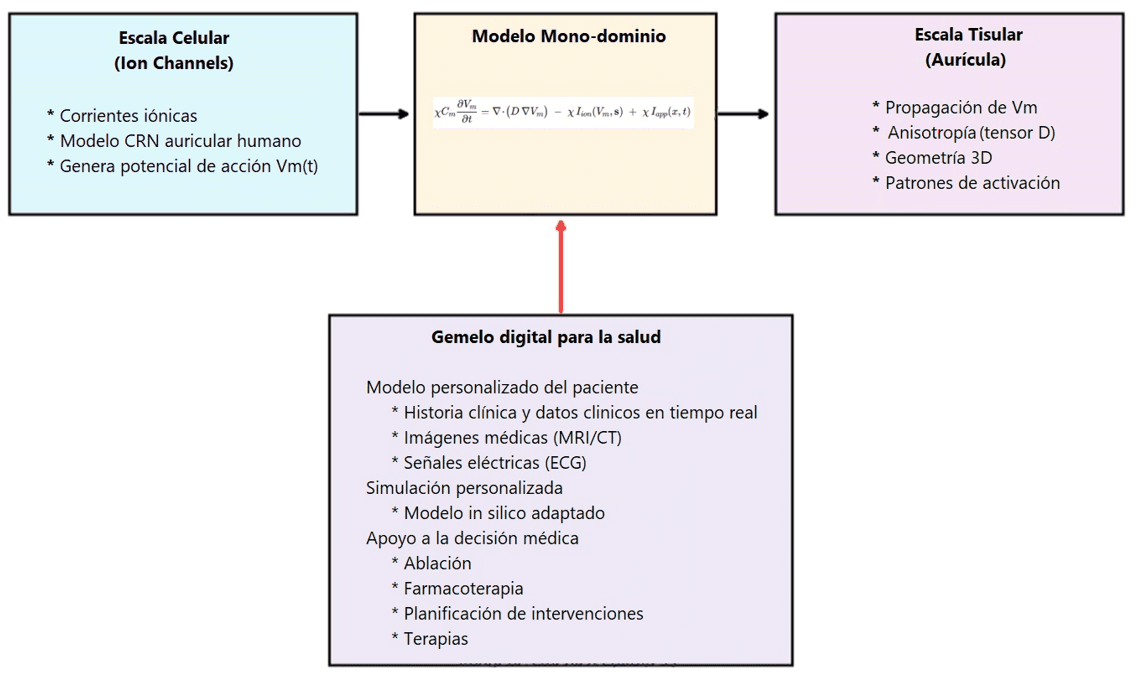
Figura 6. Esquema visual del gemelo digital que simula la electrofisiología cardíaca desde los canales iónicos hasta todo el corazón. Se muestra cómo se conectan los modelos celulares y mono dominio detallados y personalizados, las redes de propagación a nivel de tejido con geometrías precisas anatómicamente (3D). Anisotropía, propiedad de los tejidos cardiacos de comportarse de forma diferente según la dirección del potencial de acción. (Fuente: propia)
Desagregando el proceso de construcción del gemelo digital, primero se simula un corazón humano de forma tan idéntica a los datos clínicos del paciente y que se registran de forma paralela al de la simulación. El sistema experto simula el funcionamiento del corazón de forma muy confiable, y verificable con los datos clínicos del paciente. En este punto, tenemos un potente generador de datos virtual del funcionamiento del corazón, con la particularidad que puede generar datos cada milisegundo durante un periodo de tiempo, y como ya sabemos la analítica avanzada y la inteligencia artificial se ponen muy contentas cuando tienen datos.
Por ejemplo, se puede generar datos simulando con el modelo celular auricular humano de Courtemanche–Ramirez–Nattel para el término Iion durante un periodo de tiempo, almacenando dichos datos en formato CSV.
Con esos datos, se inicia la tarea de analítica avanzada, por ejemplo, en una primera etapa con el 80% de los datos para entrenar el algoritmo IA para que reconozca las características de esos datos, y con el 20% restante verificar que el modelo IA responda con una certeza cercana a 1, de tal forma, que cuando se le presente una nueva situación con datos reales al modelo celular responda lo más cerca posible a los valores clínicos del paciente.
De la misma forma, es posible que el nuevo modelo IA aprenda las características del simulador del modelo mono dominio, primero almacenando digitalmente los datos generados, y luego repitiendo tantas veces como sean necesarias el entrenamiento y validación del algoritmo IA. Muy posible, se tenga que enumerar una serie de parámetros operativos y personalizados del modelo IA para aproximar las predicciones a una certeza cercana a 1 en tiempo real.
Si hubiera necesidad de ajustar otro modelo se repite el ciclo anterior, y se puede iterar de forma sistemática utilizando alguna metodología ágil para mejorar el desempeño del equipo de investigación.
9. Funciones del Gemelo Digital
La aplicación de los Gemelos Digitales del Corazón se utilizaría para:
Simular la activación auricular en 3D.
Reproducir patrones de propagación durante fibrilación auricular.
Evaluar el efecto de fármacos (modificando los canales iónicos Iion).
Personalizar tratamientos según geometría e historial clínico del paciente.
Entre otras de acuerdo con la patología del paciente.
Por ejemplo, con esa facilidad de interactividad y análisis virtual que tiene el gemelo digital, se puede realizar pruebas sin afectar el corazón. Y así facilitar la detección temprana de posibles fallos o reducir riesgos.
Otro caso es las pruebas de fármacos, es decir, si ya tenemos el gemelo digital en funcionamiento de manera paralela al paciente, lo que se puede hacer es, medicar a gemelo digital y a ver qué pasa y cuando realmente se tenga certeza de que el gemelo digital responde correctamente a ese fármaco, recién se puede aplicar ese fármaco como la mejor terapia para ese paciente en particular.
Y aquí hay una cuestión adicional, las compañías farmacéuticas, necesitan gemelos digitales de diversos órganos para realizar pruebas. Sin embargo, en el caso específico que nos ocupa, el gemelo digital se puede utilizar para preparar fármacos y reducir el tiempo de gestión de las moléculas hasta un año cuando normalmente son más de 10 años de pruebas, con el consiguiente ahorro de costes y tiempo en la producción de fármacos. Y este punto, se puede participar o invitar o solicitar a las farmacéuticas. Mire Usted, tenemos el gemelo digital con tales características, y se puede hacer estas pruebas con lo cual, quizá o no, dependiendo del grado de destreza que tenga el gemelo digital que hayamos preparado, se pueda analizar diversas moléculas para revertir ciertas patologías. Este es el reto.
10. Validar las simulaciones
Otro de los temas para tener en cuenta es: ¿por qué debemos confiar en estas simulaciones? La validación comienza en confiar en el software, y una forma es reproducir en diferentes centros de investigación las terapias o ablaciones con ese gemelo digital de la figura 7. Entonces, recién la inteligencia artificial estará integrándose dentro de la tecnología de gemelos digitales, principalmente, validando datos clínicos en tiempo real del paciente con los que esté proporcionando el gemelo digital, también en tiempo real.
Figura 7. Gemelo Digital que simula la electrofisiología (Fuente: Propia)
Y ya se ha comentado por doctores que nos han precedido, que esta tecnología no sustituye al cuidado humano ni a la experiencia médica. O sea, siempre va a estar detrás de la decisión médica, el gemelo digital proporcionará herramientas más precisas para que el equipo médico tome decisiones personalizadas, además porque se puede tener almacenado el gemelo digital del corazón de cada paciente que haya pasado por esta terapia.
La inteligencia artificial se integra con la tecnología de los gemelos digitales cuando se valida sus datos clínicos del paciente en tiempo real, así se podría transformar la medicina cardiovascular para los próximos años. Ya no se trata de tratar a un paciente “tipo”, sino de diseñar la mejor estrategia para cada corazón concreto, con sus singularidades, su historia y su particular latir. Además, relaciona diversos campos: modelado computacional, electrofisiología, hemodinámica, modelado biomecánico y análisis avanzado con los datos de los sensores.
En particular, a la fecha tenemos modelos existentes que simulan computacionalmente el corazón en alguna de sus funciones, también denominado a estas simulaciones como ensayos in silico, por el tratamiento de los algoritmos en microprocesadores de silicio.
“Una de las aplicaciones del modelado y la simulación en medicina está cobrando mucha fuerza es el concepto de ensayos in silico, utilizado para la obtención de evidencia digital a través de un modelo de simulación y también del aprendizaje automático para el desarrollo y la evaluación de terapias, como para la medicina de precisión” {1}.
“Así que estamos muy avanzados en términos de metodologías y una de las preguntas clave es ¿por qué debemos confiar en estas simulaciones? La respuesta a esta pregunta es muy compleja, pero realmente comienza con la reproducibilidad y con la confianza en el software que usamos para las simulaciones, y en este contexto es donde el software abierto puede volverse muy importante porque permite la reproducibilidad, no solo intra laboratorio, sino también inter laboratorio, y eso es muy importante” {1}.
Y precisamente existen plataformas abiertas que permiten la reproducibilidad, como OpenCOR, OpenCARP, entre otras como VIDAA que permiten replicar los gemelos digitales.
11. Personalización de la Terapia medica
Entonces, la adopción creciente en hospitales y la madurez de cómputo nos llevan a pensar que tenemos utilizar esta tecnología. Principalmente porque nos van a dar una prevención personalizada de pacientes que así se decida. Ya hemos visto que 7 millones y medio de personas o corazones nos esperan en Perú.
Los Gemelos Digitales del Corazón son modelos computacionales personalizados del corazón que integran anatomía, mecánica, electrografía y datos clínicos del paciente. Su potencial estratégico radica en tres ejes principales:
· Mejorar decisiones clínicas individualizadas (diagnóstico, selección de terapia, planificación de intervenciones).
· Reducir costes y riesgos (menor número de procedimientos fallidos, optimización de dispositivos).
· Acelerar I+D y regulación (simulaciones para diseño de dispositivos, evidencia virtual para ensayos y aprobación regulatoria).
Su adopción creciente en hospitales y la madurez de cómputo versus la analítica avanzada y la inteligencia artificial colocan a los gemelos digitales del corazón como una tecnología transformadora en cardiología, con un futuro que va desde soportes de decisión clínica (5 años) hasta ecosistemas de salud basados en "gemelos" que gobiernen prevención y terapia personalizada (10–20 años).
Los gemelos digitales del corazón permiten simular el comportamiento del corazón de cada paciente para predecir y optimizar tratamientos antes de intervenir. Se integran en los flujos clínicos actuales y reducen costes, tiempo y riesgo.
12. Oportunidad estratégica de adopción
Así tenemos, en la tabla 1, se muestra la visión y oportunidad estratégica moderada en el mercado de tecnologías de salud digital durante 2023-2030, en especial la medicina predictiva de los gemelos digitales cardíacos, que tienen una tasa de crecimiento sostenido anual aproximadamente del 38 % anual compuesto.
Indicador global | Situación 2023 | Proyección 2030 |
Tamaño mercado global de gemelos digitales en salud | USD 1.3 Bn | USD 12.7 Bn |
Crecimiento anual del sector salud | — | +38% anual (2023–2030) |
Penetración en hospitales de la Unión Europea | <5% | esperada >40% |
Casos de uso prioritarios | Ablación FA, TRC, cirugía valvular, farmacología digital | Expansión a cardiología integral |
Tabla 1. Gemelos Digitales del Corazón: la nueva frontera de la medicina predictiva. España dispone de ecosistema pionero y tiene varias instituciones de medicina virtual cardiovascular. Bn: mil millones. CAGR: Tasa de Crecimiento Anual Compuesta (Compound Annual Growth Rate) ver Figura 8. FA: Fibrilación auricular. TRC: terapia de resincronización cardíaca. Fuente: Propia
La oportunidad estratégica que nos presenta el tamaño del mercado global de gemelos digitales en salud para el año 2030, llega a ser 12 billones de dólares americanos, es decir, habrá un crecimiento sostenido anual del 38% respecto al año 2023. Se trata de que, en el año 2030, por lo menos en Europa, que cuando un paciente llegue al hospital se le realice un diagnóstico global del corazón, ya no se le va a revisar si tiene una fibrilación o una arritmia, o si tiene tal patología en particular, se le verán todas las patologías que tiene de forma integral en ese corazón del paciente.
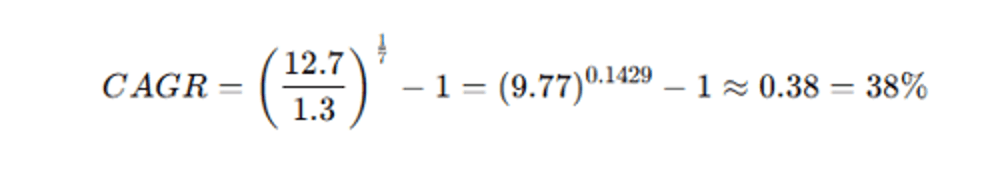
Figura 8. CAGR: Tasa de Crecimiento Anual Compuesta (Compound Annual Growth Rate).
Por otro lado, si un hospital invirtiera entre USD 250.000 y USD 450.000 para implementar un gemelo digital en 3 años. Con las áreas de impacto que se muestran en la tabla 2, se puede tener un beneficio entre el 80% y 130% beneficio neto sobre la inversión inicial en tres años, simplemente por ser más eficiente y personalizado en la terapia del paciente, cuidando la disponibilidad y descanso del equipo médico que está laborando. Es decir, si disminuye el tiempo de procedimiento en una hora, significa que está disminuyendo un 20% los costes, que ya es dinero, o si disminuye las reintervenciones por resincronización cardiaca se puede llegar a ahorrar hasta en 50% de dinero y tiempo, que va ligado directamente a la estancia hospitalaria de los tratamientos del paciente.
Además de los beneficios en la medicina preventiva: como la predicción temprana de arritmias, llevando a cabo los ensayos virtuales con la reducción del 30% en tiempo de los dispositivos de I+D, y el valor añadido para aseguradoras y fabricantes de dispositivos médicos.
Ese rango refleja que se reducen los costes clínicos (menos reintervenciones, menor tiempo de hospitalización, menos consumo de material), se aumenta la eficiencia del personal y los equipos, y, por último, se mejora la tasa de éxito de procedimientos complejos (menos fallos, menos revisiones). El ROI puede ser mayor si el hospital escala la tecnología o la ofrece a terceros (por ejemplo, simulaciones externas o formación).
Área de impacto | Situación inicial | Con gemelo digital | Mejora esperada |
Tasa de éxito de ablación FA | 65–70% | 80–85% | +20% |
Reintervenciones TRC/DAI | 25–30% | 10–15% | −40–50% |
Tiempo de procedimiento | 4–6 h | 3–4 h | −20–30% |
Estancia hospitalaria media | 3.2 días | 2.4 días | −25% |
Ahorro medio por paciente | — | 1.200–2.500 | ROI ≈ 1.8× |
Tabla 2. Reducción de procedimientos reactivos y se pasa a la terapia personalizada basada en simulaciones. FA: Fibrilación auricular. TRC: terapia de resincronización cardíaca. DAI: Desfibrilador Automático Implantable en el paciente. ROI = Beneficio total / Inversión=450.000/250.000=1.8. Fuente: Propia
En un hipotético plan de adopción y escalado de estos gemelos digitales para 3 años, se recomienda de que en el primer año se haga un piloto clínico con una valoración técnica de unos 60 pacientes de diversas patologías, en el segundo año se realice el diagnóstico integral o global a todo paciente llegue, y, además, en el tercer año, se podría escalar invitando a otros hospitales para que adopten esta tecnología.
En la tabla 3, se muestra un plan de adopción y escalado desde el primer año al tercer año. Existen factores clave para el éxito del plan. Por ejemplo: Es fundamental la colaboración público–privada (hospital + empresa + academia), así mismo, en la obtención del consentimiento informado por escrito del paciente como parte del cumplimiento del reglamento de protección de datos de los pacientes, utilización de plataformas iCloud e IA híbrida para simulación rápida, y por último posicionamiento de marca como hospital/inversor líder en innovación cardíaca.
Fases | Periodo | Hito principal | Indicador de éxito |
Piloto clínico | 0–12 mes | Validación técnica + 60 pacientes (FA/TV/TRC) | >80% precisión en predicción |
Escalado hospitalario | 12–24 mes | Integración completa en Electrofisiología / TRC | Reducción 15% costes directos |
Expansión regional | 24–36 mes | Alianza con 3 hospitales + fabricantes | ROI sostenido >2× |
Tabla 3. Camino hacia la adopción clínica y liderazgo en innovación médica. FA: Fibrilación auricular. TRC: terapia de resincronización cardíaca. TV: Taquicardia Ventricular. ROI = Beneficio total / Inversión. Fuente: Propia
Entonces el potencial estratégico de los gemelos digitales está principalmente en mejorar decisiones clínicas, y con evidencias clínicas sólidas, como he dicho, se tiene que aplicar la estandarización técnica, marcos regulatorios, y modelos de negocio que repartan el valor en beneficio del paciente.
Con los marcos regulatorios existentes, evidentemente, se tiene que respetar la dignidad de las personas cumpliendo la ley de Protección de Datos, como corresponde en el consentimiento informado escrito por el paciente.
Y si acaso fuera fructífera el uso comercial del gemelo digital, visibilizar si se puede montar una empresa con el gemelo digital que se está generando. Y será enhorabuena, porque de esa manera no solamente hay transferencia de tecnología de país a país, sino también se puede repartir, poner en valor ventajosamente una tecnología para los ciudadanos.
El gemelo digital cardíaco es una tecnología disruptiva que transformará la práctica clínica, los costes y la precisión terapéutica. Invertir ahora posiciona al hospital y al inversor en el núcleo de la medicina predictiva personalizada.
13. España HUB de medicina predictiva personalizada
Las arritmias cardíacas son las enfermedades cardíacas más comunes que causan morbilidad y mortalidad. Comprender y tratar las arritmias cardíacas sigue siendo un desafío importante en el sector cardiovascular. Si bien las técnicas experimentales proporcionan información valiosa, a menudo están limitadas en resolución, escalabilidad y personalización. Es conveniente que se desarrolle una plataforma cardíaca virtual multiescalar y multi física: un marco computacional que simule la electrofisiología cardíaca desde los canales iónicos para todo el corazón. Se utilizan los modelos celulares biofísicamente detallados y personalizados, redes de conducción a nivel de tejido y con geometrías 3D precisas anatómicamente, así mismo, el gemelo digital puede permitir la exploración mecanicista de la iniciación de la arritmia, mantenimiento y terminación en condiciones fisiológicas/patológicas normales y anormales.
A la fecha, investigadores españoles colaboran en el desarrollo de gemelos digitales del corazón, en el ámbito europeo, como en el caso de un sistema que integra electrofisiología ventricular con simulaciones personalizadas para mejorar el diagnóstico y tratamiento de arritmias.
En España, las principales iniciativas de gemelos digitales del corazón se desarrollan en centros de investigación y empresas tecnológicas, dentro de la definición aceptada por EDITH (Ecosystem Digital Twins in Health) y respaldada por la Comisión Europea, que crean réplicas virtuales del corazón, o han desarrollado un sistema de mapeo cardíaco no invasivo para la monitorización en tiempo real. Estas tecnologías permiten simular el comportamiento del corazón para predecir riesgos, personalizar tratamientos y mejorar diagnósticos.
A continuación, se muestra en la tabla 4, una lista de algunos Centros de Investigación en España que ampliaremos más detalles de cómo trabajan con gemelos digitales del corazón.
CENTRO INVESTIGACION | GEMELO DIGITAL CARDIACO | HOSPITAL |
ELEM Biotech Barcelona Supercomputing Center (BSC) - Universitat Politècnica de Catalunya - BarcelonaTech (UPC) | Virtual human twin cardiaco Detectar patologías ocultas según las características de cada paciente y probar tratamientos personalizados | Hospital Clínico de Barcelona |
CORIFY - Modelo Mono dominio Servicio de Cardiología del Laboratorio de Investigación Traslacional del Marañón, del Instituto de Investigación Sanitaria, de la Unidad de Apoyo a la Innovación, y de los investigadores de la Universidad Politécnica de Valencia. | Mapeo global del corazón en tiempo real Permite una visión detallada de su actividad eléctrica. | Hospital Universitario Gregorio Marañón |
VIDAA Universidad Pompeu Fabra (Unidad BCN MedTech del Departamento de Ingeniería) Plataforma VIDAA | Simulaciones con gemelos digitales personalizados de pacientes que van a ser operados. Permite a los cardiólogos conocer anticipadamente la morfología y el flujo sanguíneo del corazón y simular escenarios posibles de la operación. | Hospital de Burdeos (Instituto-Hospital Universitario de Enfermedades del Ritmo Cardíaco) |
COR-ITACA Modelo Bidominio Universidad Politécnica de Valencia OpenCARP | Localizar con mayor precisión el origen de las contracciones ventriculares prematuras. Mejorar la precisión de más de 30 mm a apenas 7,8 mm. | Hospital Universitario Gregorio Marañón |
BSICoS Plataforma COCORO | Predicción de riesgo y optimización de terapias Generar perspectivas nuevas para pacientes con cardiopatías hereditarias o tras infarto, usando imágenes y señales del paciente para simular “su” corazón virtual. | Hospital Clínico Universitario Lozano Blesa de Zaragoza |
ARTEMIs Instituto de Investigación Vall d’Hebron (VHIR) de Barcelona | Gemelos virtuales del hígado y del corazón Estudiar complicaciones cardiovasculares y traducir soluciones de gemelos a la práctica clínica. | Hospital Universitario Vall d'Hebron |
Tabla 4. Centros de investigación en España Fuente: Propia
La empresa spin-off ELEM Biotech, con sede en Barcelona y originada en el Barcelona Supercomputing Center (BSC), trabaja en la creación de gemelos digitales del corazón -- virtual human twin cardiaco -- para detectar patologías ocultas según las características de cada paciente y probar tratamientos personalizados. Además de personalizar terapias, los gemelos digitales también permiten anticipar problemas futuros en personas sanas mediante el análisis de escenarios, como un aumento repentino en el peso del sujeto. En paralelo, toda esta información también sirve para mejorar el desarrollo de equipamiento médico en general, y de marcapasos en este caso particular. ELEM Biotech trabaja con el Hospital Clínico de Barcelona en ensayos clínicos. {14}
En Madrid, el Hospital Universitario Gregorio Marañón presento CORIFY con certificación CE, un sistema que utiliza un chaleco especializado con electrodos e inteligencia artificial para crear un mapeo global del corazón en tiempo real, permitiendo una visión detallada de su actividad eléctrica. CORIFY ha sido el fruto de 20 años del Servicio de Cardiología del Laboratorio de Investigación Traslacional del Marañón, del Instituto de Investigación Sanitaria, de la Unidad de Apoyo a la Innovación, y de los investigadores de la Universidad Politécnica de Valencia. Se han centrado en ayudar a prever la causa de las fibrilaciones auriculares utilizando el modelo in silicio (ecuación mono dominio) que permite simular el corazón después de una captura de datos durante un periodo de 10 minutos, a fin de alimentar el algoritmo predictivo ya ajustado para el paciente que se le está atendiendo. {15}
Se trata, que cuando un paciente llega con patología cardiaca, se le coloca unos sensores en el pecho y espalda y a continuación, después de un protocolo que tienen allí y al cabo de 10 minutos, se tiene en la pantalla el corazón del paciente dibujado en 3D y latiendo de manera síncrona con la del paciente. Entonces, el médico puede estar viendo cuál la actividad eléctrica de forma detallada en cada parte del corazón. Además, el médico está revisando qué actividad eléctrica tiene ese corazón en directo y la IA le está informando posibles disfunciones o simplemente el estado del corazón del paciente para la siguiente hora.
Así mismo con la plataforma VIDAA, tenemos a los investigadores de la Universidad Pompeu Fabra (Unidad BCN MedTech del Departamento de Ingeniería) y el Hospital de Burdeos (Instituto-Hospital Universitario de Enfermedades del Ritmo Cardíaco) que han creado simulaciones con gemelos digitales personalizados de pacientes que van a ser operados, ya que les permite a los cardiólogos conocer anticipadamente la morfología y el flujo sanguíneo del corazón y simular escenarios posibles de la operación. Utilizan la plataforma VIDAA que permite generar copias virtuales de la aurícula izquierda de los pacientes con fibrilación auricular. {16}
De otro lado, un equipo de investigadores españoles de la Universidad Politécnica de Valencia perteneciente al grupo COR-ITACA {17}, han desarrollado una técnica pionera que combina imagen electrocardiográfica (ECGI) con gemelos digitales personalizados para localizar con mayor precisión el origen de las contracciones ventriculares prematuras, otra forma frecuente de arritmia que puede ser potencialmente peligrosa. Esta metodología innovadora ha logrado reducir drásticamente el margen de error en la localización del foco arrítmico, mejorando la precisión de más de 30 mm a apenas 7,8 mm. Esta mejora en la precisión diagnóstica es crucial, ya que una localización incorrecta puede comprometer significativamente la eficacia de tratamientos como la ablación por catéter, un procedimiento que requiere una precisión milimétrica para ser exitoso. El modelo bidominio se resolvió utilizando la plataforma OPENCARP para simular la propagación eléctrica en el miocardio ventricular y los campos eléctricos a través del torso. En fase de validación para ampliar tipos de arritmias. {18}
Bajo el Proyecto finalizado denominado DIGICARDIO (Digital transformation of clinical practice by using patient-specific cardiac digital twins) la Universidad de Zaragoza conjuntamente con la Unidad de Arritmias del Servicio de Cardiología del Hospital Clínico Universitario Lozano Blesa de Zaragoza plantearon crear gemelos digitales personalizados del corazón usando datos clínicos, imágenes, señales electrocardiográficas, para predicción de riesgo y optimización de terapias (terapia de resincronización, selección de pacientes post-infarto para desfibriladores). El hospital participa activamente en la creación de gemelos y en la producción de un volumen sostenido de casos. Así mismo, dentro del grupo Biomedical Signal Interpretation and Computational Simulation (BSICoS) que forma parte del instituto universitario de investigación en ingeniería de Aragón - Universidad de Zaragoza, continúan generando perspectivas nuevas para pacientes con cardiopatías hereditarias o tras infarto, usando imágenes y señales del paciente para simular “su” corazón virtual. Así mismo han creado la plataforma COCORO, un solucionador basado en WebGPU de vanguardia para un cálculo y renderizado eficientes para abordar la complejidad de los modelos electrofisiológicos cardíacos in silico. Catorce investigadores del grupo BSICoS participaron en el Congreso de Computación en Cardiología, realizado en São Paulo, Brasil, del 14 al 17 de septiembre de 2025, donde tuvieron la oportunidad de presentar sus investigaciones sobre salud cardíaca. {19}
El Instituto de Investigación Vall d’Hebron (VHIR) de Barcelona participa en el proyecto europeo AcceleRating the Translation of virtual twins towards a pErsonalized Management of fatty lIver patientS (ARTEMIs) que usan gemelos virtuales del hígado y del corazón para estudiar complicaciones cardiovasculares y traducir soluciones de gemelos a la práctica clínica. {20}
Entonces, lo principal es que siempre que queramos montar un gemelo digital, se debe tener habilitado un Centro de Investigación, verificar la masa crítica de investigadores, tanto médicos cardiólogos, como también ingenieros para discernir sobre la electrostática y la electrofisiología del corazón. Y lo más importante está en el tercer grupo: los pacientes, porque se tiene que trabajar con terapias y tratamientos de casos patológicos reales, para que el entrenamiento de la IA sea válido, como también para que los datos clínicos de los pacientes sean comprobados y validados con los datos de simulación del gemelo digital, por lo cual, la participación de los hospitales es crucial, como en el caso de CORIFY, ha funcionado y funciona, porque tiene un patrón de pacientes reales, favoreciendo una atención personalizada a los pacientes.
De tal forma que, con estos 3 vectores, centros de investigación para saber qué patología abordar, la masa crítica de médicos e ingenieros, y los pacientes, será posible para llevar a cabo el montaje de un gemelo digital.
Y es muy importante que se utilice este conocimiento, para una primera invitación a centros de investigación o institutos, para ver si tenemos o no la masa crítica y si no formarlas, a continuación, tener acuerdos con hospitales. Y luego conjuntamente, ver qué tipo de patología se puede estudiar para ayudar al potencial 23% de corazones peruanos.
Sabemos de qué cualquier en cualquier población, tienen por lo menos el 30% arritmias, y no lo saben y no se atienden. Entonces, hagamos lo posible para utilizar esta herramienta, entonces no se trata, de que se haga diagnóstico de pacientes tipo, si no, tenemos la posibilidad de que cada corazón se analice desde su singularidad, su historia, su particular latido.
14. Gemelos digitales del corazón humano en América Latina
En América Latina el uso clínico rutinario de gemelos digitales cardíacos aún es muy incipiente: la mayor parte de la actividad pública que aparece en la literatura y en prensa corresponde a proyectos de I+D, las instituciones muestran interés, posible infraestructura o antecedentes tecnológicos que permitirían pilotos académicos o iniciativas privadas/empresariales, pero hay escasas pruebas públicas claras de despliegues hospitalarios a gran escala o un despliegue clínico integrado y continuo en la región al día de hoy.
15. Conclusiones
El presente articulo tiene como finalidad generar un entorno de intercambio de conocimiento, experiencias e innovación entre todos los agentes implicados en el despliegue de la salud conectada en Lima. El propósito es avanzar colectivamente hacia una transformación digital del sistema sanitario que sea sostenible, centrada en la ciudadanía y alineada con los principios de equidad, calidad y eficiencia.
El modelo mono dominio es una simplificación matemática del modelo bidominio, que representa los espacios intracelular y extracelular, pero reduciendo la complejidad a una sola ecuación de difusión para la divergencia potencial transmembrana.
La descripción de la actividad eléctrica tiene mucha relación con el volumen de células que entran como parámetro de homogeneización del grupo de células a modelar, porque también depende la cantidad de membrana a simular con el modelo mono dominio. Sin embargo, es posible que diferentes volúmenes realmente no sean homogéneos y reaccionen de forma diferente clínicamente, pero el tratamiento con el modelo mono dominio no los diferencia.
También como un aspecto importante, la colaboración y la integración digital. Es absolutamente clave que los ecosistemas de investigación, económicos y productivos de las instituciones para las que trabajamos, compartan datos, tengan interoperabilidad de sus soluciones, de sus aplicaciones, hablen el mismo lenguaje a nivel de gobierno del dato, a nivel de semántica, a nivel de ontologías, a nivel de lenguaje, de diccionario que utilizan los mismos conceptos coherentes. En definitiva, la colaboración y la integración digital, que los datos nazcan digitales y viajen digitales.
Se dejó claro que el modelo de gemelo digital es un conjunto de principios: la colaboración público-privada, inversión en infraestructuras digitales resilientes, la integración de los datos y, sobre todo, una visión estratégica a largo plazo que de relevancia al paciente.
Los gemelos digitales del corazón tienen un potencial transformador: desde mejorar decisiones clínicas en pacientes complejos hasta cambiar cómo se diseñan y regulan dispositivos cardiovasculares. Para que ese futuro se materialice, hacen falta evidencia clínica sólida, estandarización técnica, marcos regulatorios claros y modelos eficientes para un buen resultado orientar lo que con lleva en mejorar la salud de las personas negocio que repartan el valor.
El gemelo digital cardíaco es una tecnología disruptiva que transformará la práctica clínica, los costes y la precisión terapéutica. Invertir ahora posiciona al hospital y al inversor en el núcleo de la medicina predictiva personalizada. Respecto a la vida humana que se benefician y de la eficiencia de los medios partiendo de que como sería una buena inversión puesto que hay pocos.
Desde el siglo pasado, la medicina hace uso copiosamente y sin restricciones de la estadística, de los sistemas expertos y, ahora, de la IA. La IA está cruzando la línea fina de comprender a los humanos, puesto que se está creando máquinas que se relacionan directamente con nuestro intelecto. ¿El camino está abierto para que la IA ayude más al médico? No lo tenemos todavía, pero los tendremos.
16. Referencias
{1} Open Software and Tools for Digital Twins of the Heart - Computing in Cardiology Brazil 2025 Sep 14 – 17, 2025;
Blanca Rodriguez1 and Rodrigo Weber dos Santos2
1University of Oxford, - Head of Computational Biology and Health Informatics 2Federal University of Juiz de Fora
{3} Ionic mechanisms underlying human atrial action potential properties: insights from a mathematical model. Author(s): MARC COURTEMANCHE,1,2 RAFAEL J. RAMIREZ,1 AND STANLEY NATTEL1,3,4
1Research Center, Montreal Heart Institute, Montreal, Quebec H1T 1C8; De´partements
de 2Physiologie and 4Me´decine, Universite´ de Montre´al, Montreal, Quebec H3C 3J7; and
3Department of Pharmacology, McGill University, Montreal, Quebec H3G 1Y6, Canada
{9} OpenCOR https://www.cellml.org/getting-started/tutorials/opencordemo
{10} cellML https://models.cellml.org/exposure/0e03bbe01606be5811691f9d5de10b65
https://www.researchgate.net/publication/13596150_Ionic_mechanisms_underlying_human_atrial_action_potential_properties_Insights_from_a_mathematical_model
{11} OpenCARP https://opencarp.org/ https://www.kit.edu/
{12} Computational Biology & Health Informatics https://www.cs.ox.ac.uk/research/compbio/
{13} Chaste https://chaste.github.io/
{14} The Virtual Humans Factory and Barcelona Supercomputing Center (BSC)
https://www.elem.bio/
{15} Corify Care, sistema no invasivo de mapeo del corazón en tiempo real:
https://www.comunidad.madrid/noticias/2025/03/03/hospital-publico-gregorio-maranon-crea-primer-sistema-mundo-no-invasivo-mapeo-global-corazon-tiempo-real
{16} Crean gemelos digitales del corazón para poder realizar simulaciones que reduzcan los riesgos de las operaciones de arritmias
{17} Grupo COR-ITACA: Universitat Politècnica de València, Instituto de Ingeniería Biomédica - Valencia, Instituto de Tecnología de Karlsruhe (KIT) – Alemania, Departamento de Cardiología del Hospital General Gregorio Marañón y el Instituto de Investigación Sanitaria Gregorio Marañón (IISGM), Corify Care SL., Departament de Matematiques de la Universitat Autònoma de Barcelona, Centro de Investigación Biomédica en Red de Enfermedades Cardiovasculares (CIBERCV), Universidad Complutense de Madrid.
{18} Un gemelo digital del corazón ayuda a mejorar el diagnóstico y tratamientos de arritmias cardiacas
https://www.upv.es/noticias-upv/noticia-15126-gemelo-digital-es.html
https://doi.org/10.1016/j.compbiomed.2025.109994
{19} Digital transformation of clinical practice by using patient-specific cardiac digital twins for risk prediction and therapy optimization (DIGICARDIO) – TED2021-130459B-I00
https://bsicos.i3a.es/digital-transformation-of-clinical-practice-by-using-patient-specific-cardiac-digital-twins-for-risk-prediction-and-therapy-optimization-digicardio-ted2021-130459b-i00/
Starts a new project to create digital twins of the heart
https://bsicos.i3a.es/starts-a-new-project-to-create-digital-twins-of-the-heart/
{20} Nace la iniciativa ARTEMIs para estudiar el hígado graso y sus complicaciones cardiovasculares mediante gemelos virtuales
https://vhir.vallhebron.com/es/sociedad/noticias/nace-la-iniciativa-artemis-para-estudiar-el-higado-graso-y-sus-complicaciones-cardiovasculares-mediante-gemelos-virtuales
Digital Twins Ensayos in silico Cardiología
© ExpoNet 2024
